S. Mathieu 1, B. Duval 1, J. Breault 1, J. Saguez 2 et M. Neau 3
1. Agronomes (MAPAQ) 2. Chercheur (CÉROM) 3. Coordonnateur du RAP GC (CÉROM)
- Le nombre d’ennemis naturels est en hausse dans plusieurs champs (52 % des sites suivis par le RAP). Pour identifier ces alliés qui sont présentement actifs dans les champs de soya, consultez le carnet de champ des dépisteurs du réseau de surveillance du RAP Grandes cultures ainsi que la brochure sur la lutte intégrée contre le puceron du soya.
- Les températures au-delà de 30 °C nuisent au développement du puceron.
- L’humidité relative élevée favorise le développement de champignons entomopathogènes qui peuvent faire chuter drastiquement les populations de pucerons.
Advenant qu’un traitement insecticide soit justifié, notez que plusieurs insecticides homologués contre le puceron du soya ne peuvent être appliqués lorsque le soya est en fleurs puisque les pollinisateurs peuvent être affectés par ces produits. Il est donc important de bien lire les étiquettes avant le traitement. Pour avoir accès rapidement aux mises en garde des différents produits, consultez la fiche Info traitement disponible dans le tableau des traitements phytosanitaires et risques associés sur SAgE pesticides. Avant de traiter, vérifiez si l’insecticide est autorisé par votre acheteur de grain. Certains marchés d’exportation pourraient refuser le soya s’il a fait l’objet d’un traitement.
Pour en savoir plus sur la stratégie d’intervention recommandée au Québec contre le puceron du soya, consultez l’avertissement Nº 13 du 8 juillet 2022.
ALTISES À TÊTE ROUGE OBSERVÉES SUR DU MAÏS À DES STADES VÉGÉTATIFS : PAS D’INQUIÉTUDE
B. Duval 1, S. Mathieu 1, J. Saguez 2 et M. Neau 3
1. Agronomes (MAPAQ) 2. Chercheur (CÉROM) 3. Coordonnateur du RAP GC (CÉROM)
POURRITURE À SCLÉROTES CHEZ LE SOYA : SUIVI ET VIGILANCE
Y. Dion 1, T. Copley 2 et B. Duval 1
1. Agronomes (MAPAQ) 2. Chercheuse (CÉROM)
Avec la quantité de pluie annoncée dans certaines régions et selon les conditions environnementales à l’échelle du champ, la situation est particulièrement à surveiller dans les prochains jours pour la prise d'une décision judicieuse et éclairée en ce qui concerne l’état phytosanitaire de la culture en développement. Les conditions agroclimatiques à l’échelle du champ et le stade de développement de la culture sont les facteurs majeurs du risque d’infection à prendre en compte pour une décision à ce moment. L’absence d’apothécies à ce jour est indicative que le risque a été faible jusqu’à maintenant. Le risque peut demeurer bas ou être déjà écarté, ou encore augmenter selon les facteurs suivants :
- L’état d’avancement de la culture. La floraison (stades R1 à R3) constitue la période critique pour l’infection. Dans certains cas, la culture est déjà au stade R4. Le stade R3 présente une gousse de 6 mm ou plus sur un des quatre nœuds supérieurs de la tige principale; le stade R4 est atteint lorsque des gousses d’environ 20 mm sont présentes à l’un des quatre nœuds supérieurs de la tige principale (voyez le Guide des stades sur Agri-Réseau).
- Les températures très chaudes. Certaines régions ont des températures élevées, qui sont défavorables à la germination des apothécies. Les températures inférieures à 25 °C en favorisent le développement.
- Les conditions environnementales à l’échelle du champ. L’humidité du sol dans les 5 premiers centimètres et les conditions qui favorisent un environnement humide dans la culture sont à considérer. La fermeture des rangs et des plants de grande taille sont des conditions qui maintiennent un environnement humide favorable à la germination des apothécies et à l’infection par les spores. À l’opposé, les rangs ouverts qui exposent le sol au soleil et aux vents sont des conditions desséchantes défavorables au champignon.
- L’historique du champ en culture et autres facteurs. Les risques d’infection sont évidemment associés aux niveaux d’infection observés lors des années précédentes ainsi qu’aux pratiques culturales. La sensibilité du cultivar est un moyen de lutte important à prendre en compte. Consultez la fiche technique à cet effet.
L’usage de fongicides est sans effet sur la culture si elle n’est pas encore en floraison, et n’a aucun effet sur les sclérotes du sol. L’application d’un fongicide après la floraison est peu justifiable d’un point de vue économique.
PUCERONS ET VIRUS DE LA JAUNISSE NANISANTE DE L’ORGE (VJNO)
DANS LES CÉRÉALES DE PRINTEMPS
Y. Dion 1, B. Duval 1 et T. Copley 2
1. Agronomes (MAPAQ) 2. Chercheuse (CÉROM)
Quant au virus de la jaunisse nanisante de l’orge (VJNO), qui peut être présent chez toutes les céréales à paille, il n’y a rien à faire une fois que l’infection est transmise et que la maladie est présente. Les mesures de lutte sont essentiellement préventives : un semis hâtif d’un cultivar résistant et le semis hâtif des céréales de printemps, de sorte à ce que le développement de la plante soit plus avancé au moment où le virus entre dans la culture. C’est à prendre en considération pour les prochaines saisons.
Dans certains cas, les symptômes de VJNO peuvent être « typiques » et identifiables avec certitude. Le VJNO cause une dégradation de la chlorophylle des feuilles, ce qui laisse voir d’autres pigments (carotène, anthocyanine) et donne une coloration jaune, rouge ou pourpre/violacée, selon les espèces et cultivars. La maladie se manifeste par la feuille rouge chez l’avoine. Chez l’orge, une décoloration jaune des feuilles, qui apparaissent souvent striées au départ, s’étend et devient uniforme à la surface foliaire. Ce jaunissement peut se présenter en « V », dont la base est à la pointe de la feuille de l’orge. Chez le blé, la maladie peut causer des feuilles rougeâtres ou violacées.
DÉPISTAGE DES MAUVAISES HERBES ET DÉTECTION DE RÉSISTANCES
S. Mathieu 1, B. Duval 1 et S. Flores Flores-Mejia 2
1. Agronomes (MAPAQ) 2. Chercheuse (CÉROM)
Établir un diagnostic de résistance des mauvaises herbes
Lors du dépistage, identifiez les mauvaises herbes non réprimées, leur emplacement, leur densité et leur stade. Ces observations vous permettront de saisir les raisons du mauvais contrôle. Attention! Une mauvaise herbe non contrôlée n’est pas nécessairement résistante à l’herbicide utilisé. Les éléments suivants renforcent l’hypothèse de la résistance aux herbicides :
- Seule une espèce de mauvaise herbe a survécu au traitement.
- Le motif de distribution de la mauvaise herbe au champ est aléatoire.
- Dans cette population de mauvaise herbe, le niveau de dommages dus à l’herbicide varie d’une plante à l’autre.
- Le même problème a été observé au cours des dernières années dans un même champ, lorsque des herbicides du même groupe ont été utilisés.
- Des herbicides du même groupe ont été utilisés à répétition, année après année, dans ce champ.
Si tel est le cas, le diagnostic de résistance vous permettra d’ajuster votre stratégie de désherbage pour les années à venir, et vous évitera des applications inutiles d'herbicides et des pertes de rendement.
Si vous soupçonnez un problème de résistance, des tests moléculaires et classiques de détection de la résistance sont disponibles. Consultez la trousse Résistance des mauvaises herbes pour découvrir la liste des tests de résistance disponibles, la méthode pour échantillonner les mauvaises herbes pour les tests moléculaires et classiques, et plus encore.
Au Québec, plusieurs espèces de mauvaises herbes ont déjà été diagnostiquées résistantes à certains herbicides, dont la petite herbe à poux, la morelle noire de l’Est, l’amarante à racine rouge, le chénopode blanc, la sétaire verte, la vergerette du Canada et l’amarante tuberculée. Consultez ici les résultats les plus récents concernant la détection de la résistance aux herbicides.
Si vous découvrez de l’amarante tuberculée, sachez que le Plan de lutte contre l’amarante tuberculée peut vous soutenir financièrement pour établir une stratégie de lutte, de l’arrachage, etc.
Pour éviter de sélectionner des mauvaises herbes résistantes aux herbicides, il est important de bien connaître la biologie des mauvaises herbes, de dépister les champs, d’utiliser différentes méthodes de contrôle, de faire des rotations incluant des cultures de cycles long et court, et de varier les modes d’action des herbicides. Pour vous aider à comprendre la biologie de quelques mauvaises herbes et établir une stratégie de lutte, consultez les fiches techniques sur la prêle des champs, l’armoise bisannuelle, le souchet comestible et la morelle noire de l’Est ainsi que le document Répression du laiteron des champs, du chardon des champs et du tussilage.
RAVAGEURS DU CANOLA : LA SITUATION RESTE TRANQUILLE
S. Boquel 1, H. Brassard 2 et A. Akpakouma 2
1. Chercheur (CÉROM) 2. Agronomes (MAPAQ)
Parmi les champs dépistés par le RAP Grandes cultures, seulement quelques sites au Bas-Saint-Laurent, dans la Capitale-Nationale et au Saguenay–Lac-Saint-Jean sont encore à un stade sensible à la CCF. Le canola est le plus à risque du stade rosette (BBCH 30) au stade où les boutons floraux des inflorescences secondaires sont individuellement visibles, mais encore fermés (BBCH 58). Les autres sites ont dépassé ces stades sensibles et ne sont donc plus à risque pour la CCF.
Pour les champs aux stades sensibles, les populations restent cependant faibles (voir les données).
Pour en savoir plus sur la pertinence d’un traitement ou le dépistage de l’insecte, référez-vous à l’avertissement Nº 13 du 8 juillet 2022. Pour plus d’information, consultez la fiche technique La cécidomyie du chou-fleur.
Charançon de la silique
Le dépistage du charançon de la silique tire à sa fin. Les populations restent très faibles dans l'ensemble des régions, à l’exception des trois champs suivis par le RAP en Chaudière-Appalaches et dans la Capitale-Nationale. Ces derniers sites étaient au seuil d'intervention de 20 à 40 adultes par 10 coups de filet fauchoir ou le dépassaient, alors que le canola était à un stade sensible. Pour rappel, le dépistage de ce ravageur se fait à l’aide d’un filet fauchoir, à 5 stations réparties aléatoirement dans le champ, dès l’apparition des premiers boutons floraux (BBCH 50) et jusqu’à la fin de la floraison (BBCH 69).
Pour plus d’information, consultez la fiche technique Charançon de la silique.
Jusqu’à maintenant, les captures de ce ravageur sont très faibles dans les champs dépistés par le RAP Grandes cultures. Les captures maximales ont été atteintes au Bas-Saint-Laurent, avec 275 méligèthes par 10 coups de filet fauchoir.
Le canola est plus sensible à cet insecte dès l’apparition des premiers boutons floraux (BBCH 50) et jusqu’à la mi-floraison (BBCH 65). Toutefois, compte tenu des seuils d’intervention très élevés établis en Europe (6 000 à 9 000 méligèthes par 10 coups de filet fauchoir selon la densité des plants) et des données du RAP Grandes cultures de 2011 à 2021, les risques pour la culture sont généralement faibles. Depuis 2011, la densité maximale recensée par le réseau était d’environ 850 méligèthes par 10 coups de filet fauchoir. Avec une telle densité, les méligèthes sont très visibles dans le champ et les captures paraissent impressionnantes, mais ces dernières restent tout de même sept fois inférieures au seuil européen.
Pour en savoir plus sur la biologie, la méthode de dépistage et les seuils d’intervention, consultez la fiche technique Méligèthe des crucifères.
VER-GRIS OCCIDENTAL DES HARICOTS : FAIBLES CAPTURES DE PAPILLONS POUR LE MOMENT et DÉPISTAGE DES CHAMPS DE MAÏS À RISQUE
M. Neau 1, J. Saguez 2, B. Duval 3 et S. Mathieu 3
1. Coordonnateur du RAP GC (CÉROM) 2. Chercheur (CÉROM) 3. Agronomes (MAPAQ)
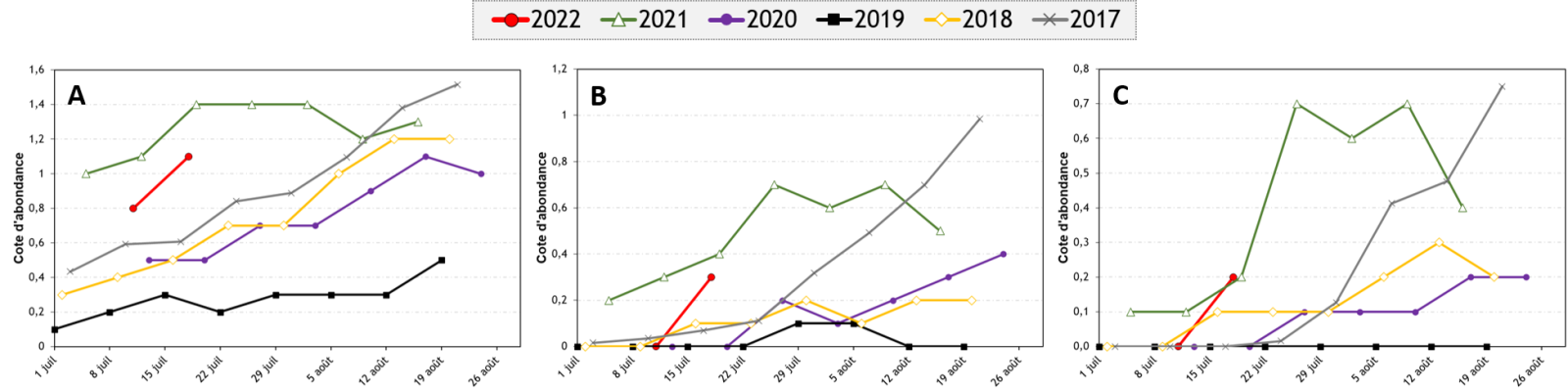
Au Québec, une cinquantaine de pièges destinés à capturer des papillons du ver-gris occidental des haricots (VGOH) sont installés pour suivre l’évolution des populations de ce ravageur et déterminer sa distribution. Durant la dernière semaine, la présence du ravageur a été détectée dans la majorité des régions (voir les données), mais les captures sont encore faibles. Elles devraient augmenter dans les prochaines semaines si l’on se fie aux données historiques.
Les captures de papillons dans les pièges ne sont qu’un indicateur des populations présentes dans une région. Elles ne permettent pas de juger de la pertinence d’une intervention dans le champ où le piège est installé. Il n’est pas rare que des champs à proximité de pièges ayant capturé plusieurs spécimens ne soient pas infestés, et à l’inverse, il peut y avoir des masses d’œufs et des larves dans un champ où un piège n’a capturé aucun papillon. La présence de papillons dans un secteur indique qu’il faut envisager le dépistage des masses d’œufs.
Les masses d’œufs sont habituellement pondues à la face supérieure des trois ou quatre feuilles du haut du plant, sur la feuille étendard ou sur des feuilles qui ont encore un port dressé, mais il faut aussi porter attention à tout le plant pour ne pas manquer de masses d’œufs ou de jeunes larves. Ces dernières sont très petites et pourraient aussi être trouvées sur les croix.
Les champs à risque (situés dans des zones sableuses ayant un historique de dommages et/ou présentant une croissance inégale des plants) devraient être dépistés à partir du stade « VT » (lorsque la panicule [croix] est présente dans le verticille [cornet]). Des croix sont déjà sorties dans certains champs au sud de la province. La ponte s’étalant sur plusieurs semaines, le dépistage des masses d’œufs et des jeunes larves peut débuter dans les champs à risque et se prolonger durant les trois à quatre semaines suivant la sortie des croix.
Pendant cette période, il est recommandé de dépister les champs tous les cinq à sept jours. Le dépistage consiste à noter le nombre de plants porteurs de masses d’œufs et de larves, en examinant le feuillage de 10 plants consécutifs sur le même rang, au minimum à 10 endroits différents, pour un total de 100 plants examinés par champ. Les masses d’œufs sont facilement repérables en regardant le feuillage à contre-jour. Il faut aussi porter attention à la couleur des œufs : ils sont blancs lors de la ponte et deviennent progressivement mauves environ 48 h avant l’éclosion.
Ennemis naturels
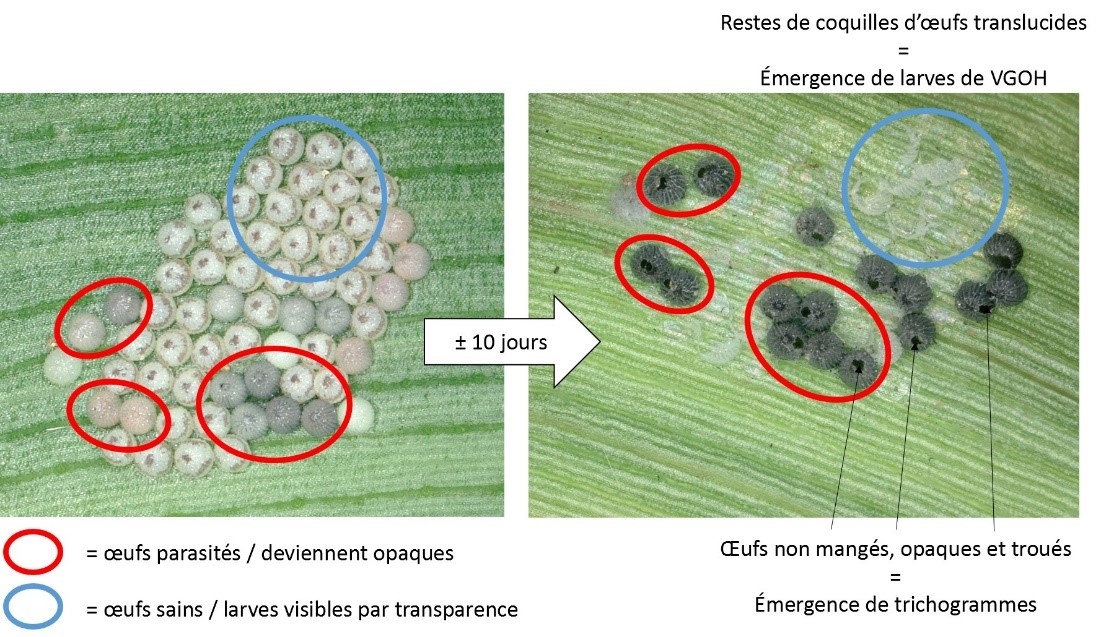
Plusieurs ennemis naturels peuvent s'attaquer aux œufs et aux jeunes larves de VGOH, telles que les larves de chrysopes, les punaises prédatrices (genres Podisius et Orius) et les coccinelles. Attention : les œufs de VGOH peuvent être confondus avec des œufs de punaises pentatomides (insectes bénéfiques). Toutefois, les œufs de VGOH ressemblent à de petits oursins dépourvus de pics, alors que ceux des punaises sont en forme de barils portant une couronne. Les œufs des deux espèces changent de couleur au fil du temps.
Les œufs peuvent également être parasités par de minuscules guêpes parasitoïdes (trichogrammes). Au champ, les masses d’œufs parasitées paraissent plus grises ou noires que mauves, et à la loupe, on peut apercevoir qu’ils sont troués à la suite de l’émergence du parasite. On peut également voir ces parasites se déplacer à la surface des masses d’œufs. Il est donc primordial de bien faire le dépistage des oeufs parasités et des ennemis naturels, car les traitements insecticides pourraient les tuer alors qu’ils procurent une certaine protection au maïs.
Seuil économique et fenêtre d’intervention
En Ontario et aux États-Unis, pour le maïs grain, le seuil d’intervention généralement utilisé est un seuil cumulatif de 5 % de plants présentant des masses d’œufs et des jeunes larves. Si à la première semaine de dépistage, 2 % des plants sont affectés, et que lors du second dépistage, 3 % des plants le sont, le seuil cumulatif de 5 % est atteint au second dépistage. Dans certains États américains, le seuil est de 8 % lorsque des ennemis naturels sont présents.
Si un traitement ciblant les larves est envisagé, il devrait être réalisé de cinq à sept jours suivant l’éclosion de la majorité des œufs, puisque les pontes sont réparties sur plusieurs semaines. L’objectif est d’atteindre les jeunes larves avant qu’elles ne rejoignent les soies, car ensuite, le traitement n’aura pas d’effet puisque les larves seront protégées à l’intérieur des épis de maïs. Si les soies ne sont pas encore sorties, il est inutile de traiter le champ.
Si un hybride Bt ciblant le VGOH (technologie Viptera) est utilisé, il n’est pas impossible que les papillons pondent dans cet hybride, mais les larves seront normalement contrôlées par cette technologie. Il pourrait y avoir des dommages sur quelques plants, issus des graines constituant le refuge et n’exprimant pas de Bt. Attention : actuellement, un seul gène confère une protection contre le VGOH. Les autres hybrides Bt qui visent d’autres papillons ou d’autres insectes ne protègent pas la culture contre le VGOH.
Consultez la fiche technique Ver-gris occidental des haricots dans le maïs pour en savoir davantage, ainsi que la vidéo Le ver-gris occidental des haricots : biologie, dépistage et stratégies d’intervention.
| Toute intervention envers un ennemi des cultures doit être précédée d’un dépistage et de l’analyse des différentes stratégies d’intervention applicables (prévention et bonnes pratiques, lutte biologique, physique et chimique). Le Réseau d’avertissements phytosanitaires (RAP) préconise la gestion intégrée des ennemis des cultures et la réduction des pesticides et de leurs risques. |