Ver-gris occidental des haricots : baisse des captures des papillons. Charbon commun : observé dans des champs de maïs. Pourriture à sclérote du soya : que faire en cas de présence de la maladie? Dépistage : échantillonnage des mauvaises herbes suspectées de résistance. Puceron du soya : les populations augmentent, mais les champs ont dépassé le stade critique.
Groupe de travail du RAP Grandes cultures sur les papillons
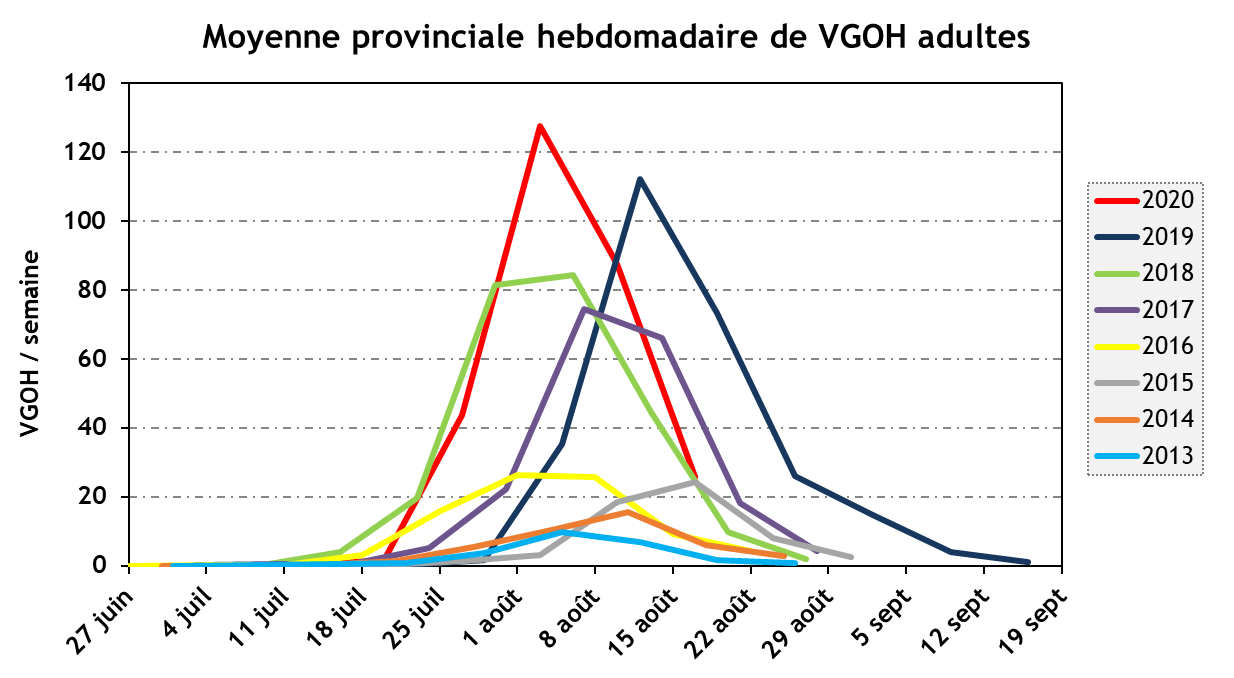
La baisse des captures de papillons du ver-gris occidental des haricots (VGOH) s’est poursuivie cette semaine (voir la figure ci-dessous), et ce, partout à travers la province. Les données du Québec et d’autres provinces canadiennes et États américains sont disponibles sous forme de carte interactive en cliquant ici.
Les premières captures de papillons ont été constatées durant la semaine du 13 juillet et depuis, des papillons ont été capturés dans tous les pièges installés (il y en a une centaine). La présence de masses d’œufs a été évaluée dans 45 champs lors de 4 dépistages consécutifs (espacés d’une semaine). Les dépistages se sont terminés la semaine dernière et des masses d’oeufs ont été trouvées dans 21 champs. Ces dépistages confirment que les papillons sélectionnent les champs pour pondre et que la quantité de papillons piégés dans un champ n’est pas un bon indicateur de la présence et de la quantité de masses d’œufs. Parmi les champs avec présence de masses d’oeufs, le nombre de plants infestés varie de 1 à 30 % (seuil cumulatif).
Au stade de brunissement des soies, le maïs est moins attractif pour la ponte. Toutefois, des masses d’œufs pourraient encore être observées sur la face supérieure des 3 ou 4 feuilles du haut du plant, sur la feuille étendard ou sur des feuilles situées plus près des épis.
Des larves plus grosses pourraient être présentes dans les épis, notamment dans les champs où des masses d’œufs ont été observées plus tôt dans la saison.
À cette période de l’année, il est trop tard pour envisager un traitement insecticide. Les jeunes larves sont protégées dès qu'elles se sont réfugiées dans les épis et l’insecticide serait alors inefficace.
Pour en savoir plus sur le dépistage du VGOH et le seuil économique d’intervention, consultez l’avertissement Nº 14 du 17 juillet 2020.
Brigitte Duval, agr. (MAPAQ)
Le charbon commun (Ustilago maydis) est une maladie observée régulièrement dans des champs de maïs. Dans la grande majorité des cas, les dommages sont très faibles et n’ont pas d’impact sur le rendement ou la qualité de la récolte. Cette année toutefois, la maladie semble un peu plus présente.
Toutes les parties aériennes du maïs (tige, feuilles, panicule, épi) peuvent être atteintes par le charbon commun. Le champignon produit des tumeurs, d’abord blanchâtres, devenant grises par la suite. Elles contiennent des masses de spores noires qui sont éventuellement libérées des tumeurs. Au moment de l’infection, qui peut se produire à différents moments de la saison, les tumeurs se développent aux endroits où la plante est en croissance active. Sur les feuilles, les tumeurs restent généralement pâles, elles finissent par durcir et elles contiennent peu de spores. Sur les épis, des grains peuvent être remplacés par des tumeurs. Sur les tiges, les tumeurs peuvent entraîner la verse des plants. Sur un plant, l’infection est localisée et elle ne se répandra pas. Par exemple, des tumeurs peuvent se développer sur quelques grains seulement (à la suite de l’infection par les soies), alors que les autres grains demeureront sains.
Le charbon commun ne produit pas de mycotoxines. Une présence importante de la maladie peut entraîner une diminution de la valeur énergétique de l’ensilage. Certaines précautions peuvent être prises pour favoriser une meilleure fermentation lors de la mise en silo. Quoi qu’il en soit, la présence de cette maladie ne devrait pas empêcher l’ensilage d’un champ affecté.
Les spores du charbon commun survivent aisément dans les résidus de cultures et le sol. Bien que l’infection soit possible sans que le plant soit blessé (par exemple, l’infection peut se produire par les soies), elle est favorisée par les blessures. Les dommages d’insectes tels que la punaise brune, les blessures causées par un passage de machinerie, la grêle, l’abrasion par le sable, etc. offrent des portes d’entrée pour cette maladie. De plus, elle est favorisée par la surfertilisation azotée, des dommages d’herbicides et des conditions de sécheresse.
Aucun fongicide n’est efficace pour lutter contre le charbon commun. Certains hybrides de maïs peuvent être plus tolérants à la maladie. Par contre, la meilleure approche consiste à utiliser des moyens de prévention tels qu’une fertilisation adéquate, la prévention des dommages d’insectes et des blessures mécaniques, etc.
Pour en savoir plus, consultez la fiche IRIIS phytoprotection en cliquant ici.
Yves Dion, agr. (MAPAQ), Yvan Faucher, agr. (MAPAQ) et Isabelle Fréchette, agr. (CÉROM)
Bien que les conditions aient été généralement peu favorables au développement de la pourriture à sclérote du soya (moisissure blanche), des plants de soya peuvent actuellement montrer des symptômes de la maladie dans certains champs (photo 2). Cependant, une application tardive de fongicide ne devrait pas être envisagée : selon D. L. Smith de l’Université du Wisconsin, il n’a pas été possible de démontrer que des applications de fongicides effectuées après le stade R4 du soya se traduisent par un bénéfice économique. Dans le cadre des activités du RAP, la totalité des 61 champs de soya dans lesquels s’effectue le dépistage du puceron du soya est rendue au stade R5 ou R6.
Une application tardive de fongicide n’est pas en mesure de réprimer efficacement la maladie. La plupart des fongicides sont homologués jusqu’au stade R3. L’importante masse foliaire du haut des plants à des stades plus avancés ne permettra pas au traitement d’atteindre les parties basses des plants qui sont infectées et envahies par le champignon. L’application d’un fongicide est de nature préventive, donc elle doit être faite avant l’infection et n’a pas de valeur curative. Le fongicide ne pourrait que protéger les tissus formant la canopée supérieure des plants, mais ne pourra réprimer le champignon dans les tissus atteints. La tige principale envahie par le champignon est bloquée et il s’ensuit une restriction de la montée de sève ayant un impact sur le remplissage des gousses. De plus, un passage avec le pulvérisateur dans la culture à cette période de l’année peut causer des dommages non négligeables, en écrasant les plants.
Par ailleurs, le temps sec et chaud en début de saison a entraîné une apparition tardive des spores, soit après le stade R3. La période la plus critique pour la culture est à la floraison (stades R1 à R3), période pendant laquelle les conditions chaudes et sèches se sont maintenues et ont été défavorables à l’infection.
Toutefois, la pression de la maladie n’est pas seulement influencée par les conditions météorologiques, mais aussi par l’historique de la maladie, les conditions spécifiques du champ et le choix du cultivar. L’étendue de l’infection dans les champs affectés sera tributaire de ces conditions; les foyers d’infection peuvent être circonscrits ou diffus.
Pour rappel, en période de floraison, le choix d’appliquer ou non un fongicide doit reposer sur une évaluation du risque pour chaque champ. Lorsque le risque est faible, un traitement a peu de chance d’être rentable même lorsque le soya est à une période critique pour l’infection.
Que faire en cas de présence de la maladie?
Si on observe la maladie, certaines mesures pourront être prises au moment de la récolte et en postrécolte :
- Éviter la dispersion des sclérotes en récoltant en dernier les champs infestés. Nettoyer l’équipement qui a servi à la récolte d’un champ affecté avant de récolter un champ sain.
- Éviter l’utilisation de la paille de soya infectée comme litière, car la paille contient des sclérotes qui seront éventuellement retournés au champ.
- Tenir un registre des champs qui ont été les plus affectés par la maladie. Les risques de pertes causées par la pourriture à sclérotes sont plus élevés dans les champs qui ont déjà subi des pertes importantes au cours des cinq dernières années.
Pour plus de détails sur les méthodes préventives et de lutte, consultez la fiche technique La pourriture à sclérotes chez le soya.
Groupe de travail du RAP Grandes cultures sur la malherbologie
La saison de culture 2020 tire maintenant à sa fin. La fin de saison représente une occasion privilégiée de marcher vos champs et d’évaluer l’efficacité des moyens de désherbage appliqués pendant l’année. Lors de ce dépistage, il est important de garder un œil attentif aux possibles cas de mauvaises herbes résistantes aux herbicides. Un diagnostic de la résistance vous permettra d’ajuster votre stratégie de culture et de désherbage pour l’année à venir et pourra ainsi vous éviter des applications inutiles d'herbicides, des coûts additionnels engendrés par un second désherbage et des pertes de rendement causées par la compétition entre les mauvaises herbes résistantes non réprimées et la culture.
Attention! Une mauvaise herbe non réprimée n’est pas nécessairement résistante à l’herbicide utilisé. Certains éléments renforcent l’hypothèse de la résistance aux herbicides :
- Seule une espèce de mauvaise herbe a survécu au traitement.
- Le patron de distribution de la mauvaise herbe est aléatoire.
- Dans cette population de mauvaise herbe, le niveau de dommages dus à l’herbicide varie d’une plante à l’autre.
- Le même problème a été observé au cours des dernières années dans ce champ lorsque des herbicides du même groupe ont été utilisés.
- Des herbicides du même groupe ont été utilisés à répétition, année après année, dans ce champ.
Si vous soupçonnez être en présence de mauvaises herbes résistantes, des tests moléculaires et classiques de détection de la résistance sont disponibles. Cliquez ici pour connaître la liste de tests moléculaires disponibles. Il est recommandé d’envoyer des feuilles et des graines pour ce type de test. En effet, ces tests vérifient la présence de certaines mutations, mais d’autres mutations sont parfois possibles. Dans le cas d’un test moléculaire négatif, un test classique pourra alors être effectué sur votre échantillon. Si le test moléculaire n’a pas encore été développé pour l’espèce de mauvaise herbe et le groupe d’herbicides que vous visez, il est aussi possible de tester la résistance par le test classique. Pour cette méthode, il est nécessaire d’avoir des graines matures, d’où l’importance du dépistage de fin de saison.
Tous les échantillons doivent être envoyés au Laboratoire d’expertise et de diagnostic en phytoprotection (LEDP). La date limite pour la réception des échantillons pour le test classique est le 27 novembre 2020. Il n’y a toutefois pas de date limite pour les tests moléculaires. Cliquez ici pour en savoir plus sur les procédures d’échantillonnage pour les deux types de tests, la procédure d’envoi des échantillons au laboratoire et le coût associé. Les tests sont gratuits pour les entreprises en régie biologique et pour la relève agricole. Dans le cas de l’amarante tuberculée, les frais de dépistage, d'envoi d’échantillon, d'identification et de détection de la résistance peuvent être couverts par le « Plan d’intervention phytosanitaire pour lutter contre l’amarante tuberculée ». Pour plus d’information, consultez le site Web suivant : www.amarantetuberculee.ca.
Si une résistance est suspectée, il est aussi important de prendre des mesures pour éviter que les graines matures des mauvaises herbes tombent au sol et augmentent ainsi la banque de semences du sol. Pour plus d’information sur les différentes mesures de prévention et de gestion de la résistance, nous vous invitons à consulter la fiche technique produite à cet effet et la trousse « Résistance des mauvaises herbes pour 2020 ».
Au Québec, plusieurs espèces de mauvaises herbes ont déjà été diagnostiquées résistantes à certains herbicides, dont la petite herbe à poux, la morelle noire de l’Est, l’amarante à racine rouge, le chénopode blanc, la sétaire verte, la vergerette du Canada et l’amarante tuberculée. Cliquez ici pour consulter les résultats de la détection de la résistance aux herbicides des saisons précédentes.
Pour des renseignements complémentaires, vous pouvez contacter le Laboratoire d’expertise et de diagnostic en phytoprotection au 418 643-5027, poste 2718 ou à phytolab@mapaq.gouv.qc.ca.
Dans les champs surveillés par le RAP, les populations de puceron du soya ont encore augmenté depuis la semaine dernière, avec une moyenne provinciale passant de 96 pucerons par plant à 136. Les populations moyennes ont dépassé le seuil d’alerte de 250 pucerons par plant dans 8 des 65 champs dépistés cette semaine.
Toutefois, tous les champs dépistés sont maintenant rendus au stade R5 ou R6. À partir du stade R5 (présence de graines d’environ 3 mm dans une gousse à l’un des 4 nœuds supérieurs de la tige principale), un traitement insecticide aurait peu de chance d’être rentable. La présence d’ennemis naturels a également été observée dans 55 champs incluant tous ceux qui ont atteint le seuil d’alerte.
Cliquez ici pour accéder au tableau montrant le nombre de sites suivis par région, la densité de pucerons et le stade de croissance du soya dans les champs suivis par le RAP.
Pour en savoir plus sur la stratégie d’intervention contre le puceron du soya et sur l’identification de ses ennemis naturels, veuillez consulter le bulletin d’information N° 22 du 16 juillet 2015 (mis à jour le 29 juillet 2016).
| Toute intervention de contrôle d’un ennemi des cultures doit être précédée d’un dépistage et de l’analyse des différentes stratégies d’intervention applicables (prévention et bonnes pratiques, lutte biologique, physique et chimique). Le Réseau d’avertissements phytosanitaires (RAP) préconise la gestion intégrée des ennemis des cultures et la réduction des risques associés à l’utilisation des pesticides. |
Pour des renseignements complémentaires, vous pouvez contacter l’avertisseuse du réseau Grandes cultures ou le secrétariat du RAP. La reproduction de ce document ou de l’une de ses parties est autorisée à condition d'en mentionner la source. Toute utilisation à des fins commerciales ou publicitaires est cependant strictement interdite. Le Réseau d'avertissements phytosanitaires (RAP) a pour mission d'informer les producteurs et autres intervenants du domaine agroalimentaire québécois au sujet de la présence et de l'évolution des ennemis des cultures dans leurs régions respectives, et des meilleures stratégies pour les gérer. Les communiqués du RAP Grandes cultures sont diffusés gratuitement par ces trois canaux : par courriel, via le site Web d’Agri-Réseau et via Twitter.